Autora: Verónica Pinos-Universidad de Cuenca
La termodinámica es la ciencia de la energía; la palabra termodinámica viene de las palabras griegas therme que significa calor y dymanis que significa fuerza.
Imágenes: Thermodynamics - wikimedia
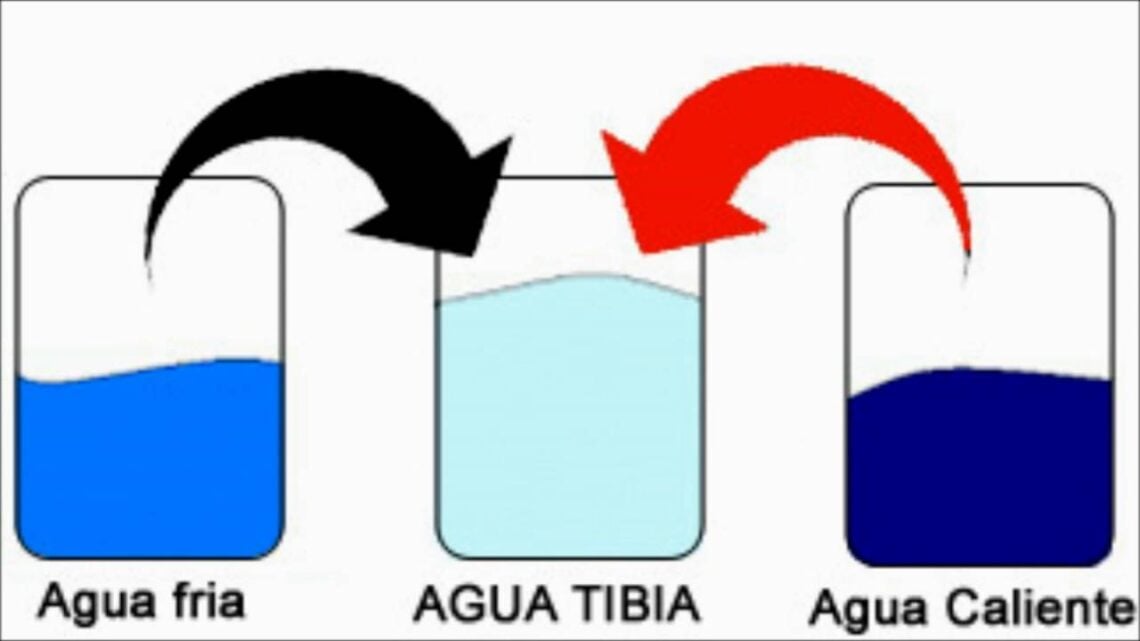
La ley cero de la termodinámica o de calor establece que, si un cuerpo A se encuentra en equilibrio térmico con un cuerpo B, y este se encuentran en equilibrio térmico con un cuerpo C, A y C también están en equilibrio; es decir, los tres cuerpos, A, B y C, se encuentran en equilibrio térmico entre sí. Por tanto, el equilibrio térmico es transitivo.
La primera ley de la termodinámica o principio de conservación de la energía establece que la energía no se puede crear ni destruir durante un proceso, pero si puede ser transformada. La energía en un sistema aislado es constante, pero puede darse un intercambio de energía, asociado al calor y al trabajo, desde o hacia el entorno. 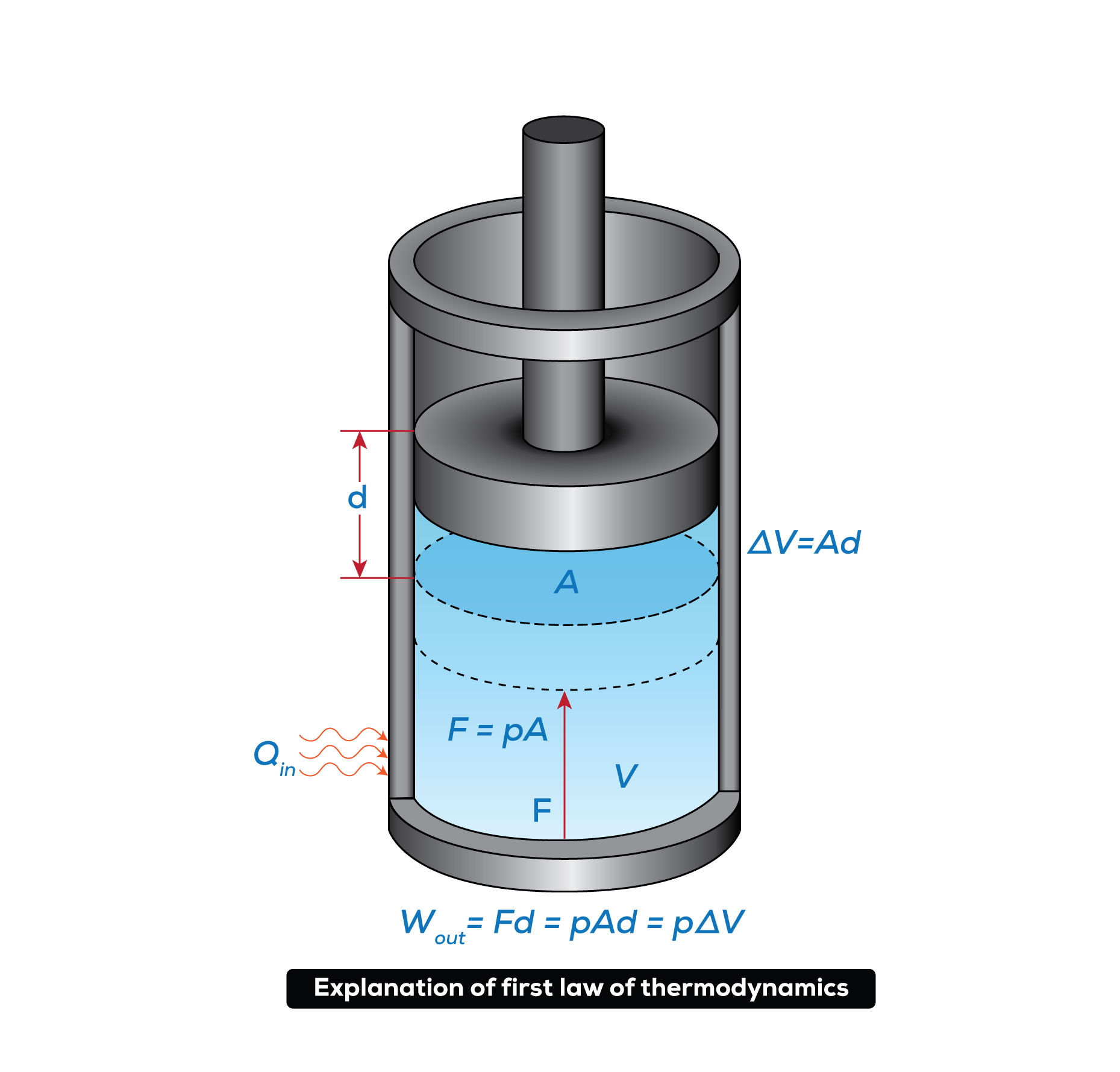
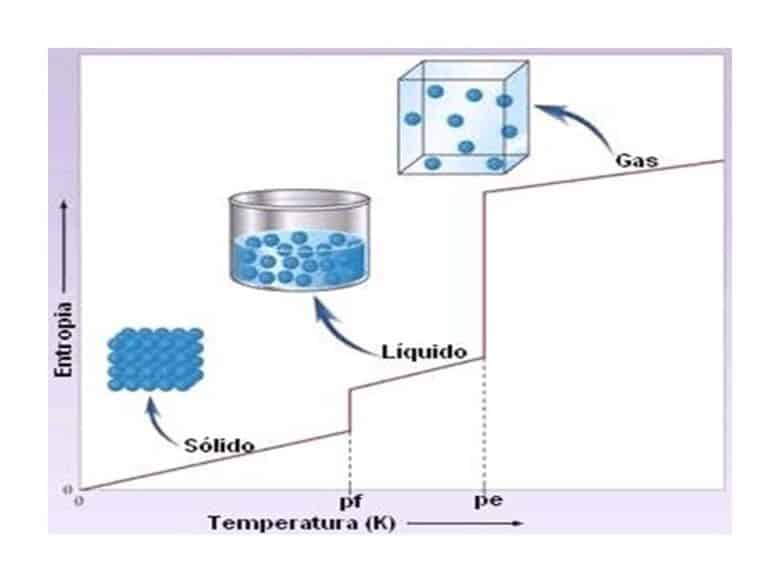
La segunda ley de la termodinámica nos dice que es imposible que en un proceso cíclico el único resultado sea la absorción de calor de un reservorio y su total conversión en trabajo entregado al exterior del sistema. Es decir, es imposible transformar todo el calor en trabajo. Los cambios espontáneos siempre resultan en un aumento de la entropía del universo y en la disipación de la energía que se acumula en forma desordenada como energía térmica o de movimiento molecular. En otras palabras, este principio explica la irreversibilidad de los fenómenos físicos, especialmente durante el intercambio de calor e indica que la cantidad de entropía del universo tiende a incrementarse.
Finalmente, la tercera ley o principio de la imposibilidad de alcanzar un cero absoluto de temperatura hace referencia a los sistemas que están en equilibrio interno cuando su temperatura es cercana al cero absoluto, -273,15° C o 0 K. Este principio afirma que, para cualquier sustancia pura, cristalina y perfecta, la entropía debe ser nula en el cero absoluto. De esta ley se deduce que no se puede alcanzar el cero absoluto en ningún proceso final asociado al cambio de entropía.
Bibliografía:
- Capparelli, A. (2013). Físico Química Básica (1ra ed.). UNLP-Edulp.
- Sears, F. W., & Salinger, G. (1978). Termodinámica teoría cinética y termodinámica estadística. Reverté.
- Cengel, Y., & Boles, M. (2015). Termodinámica (Edición: 7). McGraw-Hill Interamericana de España S.L.
Sobre autor/a
Verónica Pinos
Investigadora titular de la Universidad de Cuenca. Ingeniera Química. Investigadora en el Departamento de Recursos Hídricos y Ciencias Ambientales de la Universidad de Cuenca.





